CREADO
POR: ELVER JOSE URIBE FLOREZ
GRADO:
11-3T
ALCOHOLES
PROPIEDADES:
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). A diferencia de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la molécula de agua y le permite formar enlaces de hidrógeno. La solubilidad de la molécula depende del tamaño y forma de la cadena alquílica, ya que a medida que la cadena alquílica sea más larga y más voluminosa, la molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes. A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación con otros tipos de enlaces, se forman en gran número entre las moléculas, configurando una red colectiva que dificulta que las moléculas puedan escapar del estado en el que se encuentren (sólido o líquido), aumentando así sus puntos de fusión y ebullición en comparación con sus alcanos correspondientes. Además, ambos puntos suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). A diferencia de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la molécula de agua y le permite formar enlaces de hidrógeno. La solubilidad de la molécula depende del tamaño y forma de la cadena alquílica, ya que a medida que la cadena alquílica sea más larga y más voluminosa, la molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes. A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación con otros tipos de enlaces, se forman en gran número entre las moléculas, configurando una red colectiva que dificulta que las moléculas puedan escapar del estado en el que se encuentren (sólido o líquido), aumentando así sus puntos de fusión y ebullición en comparación con sus alcanos correspondientes. Además, ambos puntos suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
PROPIEDADES
QUIMICAS:
Los
alcoholes pueden comportarse como ácidos o bases gracias a que el grupo
funcional es similar al agua, por lo que se establece un dipolo muy parecido al
que presenta la molécula de agua.
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a un carbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a un carbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
GRAFICAS DE LOS ALCOHOLES:
USOS:
Los alcoholes tienen una gran gama de usos en la industria y en la ciencia como disolventes y combustibles. El etanol y el metanol pueden hacerse combustionar de una manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y disponibilidad para disolver sustancias no polares, el etanol es utilizado frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla. Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
RIESGOS DEL ALCOHOL PARA LA SALUD:
Consumir alcohol en exceso durante mucho tiempo aumenta la posibilidad de:
Sangrado del esófago (el conducto que conecta la garganta con el estómago) o del estómago.
Inflamación y daños en el páncreas. El páncreas produce sustancias que el cuerpo necesita para funcionar bien.
Daño al hígado. Cuando es grave, a menudo lleva a la muerte.
Mala nutrición.
Cáncer de esófago, hígado, colon, cabeza y cuello, mamas y otras áreas.
BENEFICIOS DEL ALCOHOL PARA LA SALUD:
Incrementa el colesterol bueno:
Tanto la cerveza como el vino pueden elevar los niveles de lipoproteínas de alta densidad (HDL, en inglés), capaces de retirar el colesterol de las arterias y transportarlo de regreso al hígado para ser eliminados. Esto permite prevenir diferentes enfermedades, como puede ser la arteriosclerosis.
Ayuda a prevenir enfermedades del corazón:
Diferentes estudios han concluido que los antioxidantes del vino tinto ayudan a la salud del corazón y el sistema cardiovascular. De acuerdo a otras investigaciones, una persona que realiza ejercicio y consume una bebida alcohólica por semana tiene 50% menos chance de desarrollar una enfermedad cardíaca que un individuo sedentario.
Reduce la artritis:
El alcohol puede reducir el riesgo de sufrir artritis en la vejez, aunque es bueno recordar que su consumo en exceso puede elevar los riesgos de desarrollar osteoporosis.
NOMBRE Y ESTRUCTURA DE LOS ALCOHOLES MAS REPRESENTATIVOS:
Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación.
BIBLIOGRAFIA:
http://es.wikipedia.org/wiki/Alcohol
http://www.salud.com.ar/es/siete-beneficios-del-alcohol-para-la-salud.html
http://www.sabelotodo.org/quimica/alcoholes.html
http://www.salud.com.ar/es/siete-beneficios-del-alcohol-para-la-salud.html
http://www.sabelotodo.org/quimica/alcoholes.html
ETERES
PROPIEDADES QUIMICAS:
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
PROPIEDADES FISICAS:
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
GRAFICAS DE LOS ETERES:
USOS DE LOS ETERES:
Medio para extractar para concentrar ácido acético y otros ácidos.Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores Diésel.
Fuertes pegamentos
Antinflamatorio abdominal para después del parto, exclusivamente uso externo.
RIESGOS DE LOS ETERES PARA LA SALUD:
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
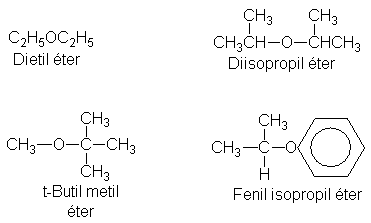
NOMBRE Y ESTRUCTURAS QUIMICAS DE LOS ETERES:
Los éteres son compuestos de fórmula general R-O-R, Ar-O-R o Ar-O-Ar.
Para designar los éteres, por lo general se indican los dos grupos unidos al oxígeno, seguidos de la palabra éter:
BIBLIOGRAFIA:
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-eteres/http://www.google.com.co/imgres?hl=es&biw=1280&bih=856&tbm=isch&tbnid=b05gc85hVbqV5M:&imgrefurl=http://www.100ciaquimica.net/fororg/eteres.htm&docid=VFDZSCqRHJi6EM&imgurl=http://www.100ciaquimica.net/images/fororg/ima/eter3.gif&w=536&h=294&ei=rJDsUaL7AY_i8gSysoHoCA&zoom=1&ved=1t:3588,r:49,s:0,i:237&iact=rc&page=3&tbnh=164&tbnw=299&start=44&ndsp=27&tx=252&ty=43
http://www.google.com.co/imgres?hl=es&biw=1280&bih=856&tbm=isch&tbnid=qEs5GmXttFdB6M:&imgrefurl=http://ca.wikipedia.org/wiki/%25C3%2588ter&docid=ygONG41Ncc26mM&imgurl=http://upload.wikimedia.org/wikipedia/commons/7/72/Preparacio_eters.PNG&w=503&h=165&ei=rJDsUaL7AY_i8gSysoHoCA&zoom=1&ved=1t:3588,r:12,s:0,i:118&iact=rc&page=1&tbnh=107&tbnw=328&start=0&ndsp=17&tx=273&ty=55
http://es.wikipedia.org/wiki/%C3%89ter_%28qu%C3%ADmica%29#Usos_de_los_.C3.A9teres
http://espanol.answers.yahoo.com/question/index?qid=20100518192545AATmuo5
http://organica1.org/qo1/ok/eteres/eter1.htm
ESTRES
PROPIEDADES FISICAS:
Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son: Aislantes eléctricos en fusión y en disolución.
Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua.
Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…)
A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula.
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.
La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
GRAFICAS DE LOS ESTERES:

USOS DE LOS ESTERES:
Muchos ésteres tienen un olor característico, lo que hace que se utilicen ampliamente como sabores y fragancias artificiales. Por ejemplo:
* metil butanoato: olor a piña
* metil salicilato (aceite de siempreverde): olor de las pomadas Germolene™ y Ralgex™ (Reino Unido)
* etil metanoato: olor a frambuesa
* pentil etanoato: olor a plátano
* pentil pentanoato: olor a manzana
* pentil butanoato: olor a pera o a albaricoque
* octil etanoato: olor a naranja.
RIESGOS PARA LA SALUD:
Los estudios han mostrado daños en el hígado, riñones, pulmones y testículos. Por otra parte, un estudio japonés publicado en 2006 realizado con primates jóvenes no ha encontrado daños testiculares de ningún tipo. El Instituto de Sanidad y Protección al Consumidor de la Oficina Química Europea ha encontrado que dos de los ftalatos considerados peligrosos para el hombre y prohibidos en la UE (el DINF o diisononilftalato y el DIDP o diisodecilftalato) no suponen un riesgo para la salud humana o para el medio ambiente en su formas de uso actuales.
También causa confusión en animales como roedores.
El MINISTERIO DE SALUD ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de (TRES) 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos, ante la posibilidad de que tengan efectos adversos sobre la salud el COMITE CIENTIFICO SOBRE TOXICIDAD, ECOTOXICIDAD Y MEDIO AMBIENTE de la UNION EUROPEA ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de (TRES) 3 años.
Que hasta la fecha no se ha validado un método de migración específica de los ésteres de ácido ftálico a partir de los materiales que los contienen, bajo condiciones reales de uso, lo que impide el establecimiento de límites admisibles para la migración de los ésteres de ácido ftálico en juguetes y artículos de puericultura.
Que en ejercicio de la capacidad del Estado Nacional para determinar los requisitos esenciales de seguridad que deben cumplir los productos de venta libre y/o de uso masivo para garantizar a la población que las sustancias empleadas no comprometen su seguridad en condiciones previsibles de uso, el MINISTERIO DE SALUD dictó la Resolución N° 978/99.
BENEFICIOS:
Los ésteres de ácidos salicílico se utilizan en medicina. Ejemplo: el ácido acetil salicílico (aspirina), el salicilato de metilo y el salicilato de fenilo.
NOMBRE Y ESTRUCTURA DE LOS ETERES MAS IPORTANTES:
BIBLIOGRAFIA:
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-esteres/
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=_iHRi8Nzz3wipM:&imgrefurl=http://gybuquimicaorganica.wikispaces.com/11.%2B%25C3%2589steres&docid=Y0gwETw85ayLyM&imgurl=http://gybuquimicaorganica.wikispaces.com/file/view/Formula.JPG/105534689/Formula.JPG&w=176&h=179&ei=8iXtUcrtF5Ts8gT0z4GIBA&zoom=1&ved=1t:3588,r:1,s:0,i:80&iact=rc&page=1&tbnh=143&tbnw=140&start=0&ndsp=19&tx=118&ty=61
http://www.google.com.co/imgres?biw=1280&bih=856&tbm=isch&tbnid=xwDJzrf-Suny2M:&imgrefurl=http://www.kalipedia.com/popup/popupWindow.html%3Fanchor%3Dklpcnafyq%26tipo%3Dimprimir%26titulo%3DImprimir%2BArt%25C3%25ADculo%26xref%3D20080506klpcnafyq_1.Kes&docid=la9CJVRigW4DhM&imgurl=http://www.kalipedia.com/kalipediamedia/cienciasnaturales/media/200805/10/fisicayquimica/20080510klpcnafyq_2_Ies_SCO.jpg&w=530&h=200&ei=SSbtUcP-LIv69gSf1IAo&zoom=1&ved=1t:3588,r:10,s:0,i:113&iact=rc&page=1&tbnh=117&tbnw=310&start=0&ndsp=14&tx=161&ty=62
http://es.answers.yahoo.com/question/index?qid=20090616154709AAnzwta
http://medicina.usac.edu.gt/quimica/acarb/Esteres.htm
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=pPSHTFhkVvIsLM:&imgrefurl=http://www.guatequimica.com/tutoriales/accarb/Esteres.htm&docid=ZEQNhwC69EGcOM&imgurl=http://www.guatequimica.com/tutoriales/accarb/esteres.gif&w=685&h=398&ei=pCrtUZT-IoiK9AT3uICACw&zoom=1&ved=1t:3588,r:6,s:0,i:95&iact=rc&page=1&tbnh=171&tbnw=295&start=0&ndsp=19&tx=76&ty=67
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=Yr_5sb0QTtBpzM:&imgrefurl=http://es.wikipedia.org/wiki/Nomenclatura_de_funciones_org%25C3%25A1nicas_con_ox%25C3%25ADgeno&docid=jSqCIPGrC7b0FM&imgurl=http://upload.wikimedia.org/wikipedia/commons/8/8b/%2525C3%252589STERES_MONOCARBOX%2525C3%25258DLICOS.png&w=1007&h=477&ei=pCrtUZT-IoiK9AT3uICACw&zoom=1&ved=1t:3588,r:1,s:0,i:80&iact=rc&page=1&tbnh=146&tbnw=300&start=0&ndsp=19&tx=262&ty=72
http://www.google.com.co/imgres?start=115&sa=X&biw=1280&bih=856&tbm=isch&tbnid=Bvvg72ATfDj7PM:&imgrefurl=http://corinto.pucp.edu.pe/quimicageneral/contenido/72-grupos-funcionales&docid=Zdoz1VjkBlYJvM&imgurl=http://corinto.pucp.edu.pe/quimicageneral/sites/corinto.pucp.edu.pe.quimicageneral/files/images/unidad7/esteres%252520con%252520olor.jpg&w=974&h=201&ei=8SvtUevSKIOG9gST84CACw&zoom=1&ved=1t:3588,r:25,s:100,i:79&iact=rc&page=6&tbnh=59&tbnw=284&ndsp=27&tx=207&ty=12
Estos minerales son los que dificultan que otras sustancias se disuelvan correctamente en el agua, como puede ocurrir en el caso del jabón a la hora de lavar la ropa. Asimismo, las aguas duras dejan más residuos, por ejemplo la cal en desagües y tuberías, provocando así problemas en el hogar. Es por este motivo que en las zonas geográficas con aguas duras, se recomienda usar productos que eviten la formación de cal.
MEDIAS:
Aunque el agua dura y el agua blanda son las más conocidas popularmente, también podemos encontrar una dureza media del agua. Será aquella que se sitúa en los niveles intermedios entre la considerada dura y la blanda en base a la cantidad de minerales que posee.
El agua más blanda es el agua destilada, por el hecho de no poseer ningún mineral y no es apta para el consumo humano.
3-
También causa confusión en animales como roedores.
El MINISTERIO DE SALUD ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de (TRES) 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos, ante la posibilidad de que tengan efectos adversos sobre la salud el COMITE CIENTIFICO SOBRE TOXICIDAD, ECOTOXICIDAD Y MEDIO AMBIENTE de la UNION EUROPEA ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de (TRES) 3 años.
Que hasta la fecha no se ha validado un método de migración específica de los ésteres de ácido ftálico a partir de los materiales que los contienen, bajo condiciones reales de uso, lo que impide el establecimiento de límites admisibles para la migración de los ésteres de ácido ftálico en juguetes y artículos de puericultura.
Que en ejercicio de la capacidad del Estado Nacional para determinar los requisitos esenciales de seguridad que deben cumplir los productos de venta libre y/o de uso masivo para garantizar a la población que las sustancias empleadas no comprometen su seguridad en condiciones previsibles de uso, el MINISTERIO DE SALUD dictó la Resolución N° 978/99.
BENEFICIOS:
Los ésteres de ácidos salicílico se utilizan en medicina. Ejemplo: el ácido acetil salicílico (aspirina), el salicilato de metilo y el salicilato de fenilo.
NOMBRE Y ESTRUCTURA DE LOS ETERES MAS IPORTANTES:
BIBLIOGRAFIA:
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-esteres/
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=_iHRi8Nzz3wipM:&imgrefurl=http://gybuquimicaorganica.wikispaces.com/11.%2B%25C3%2589steres&docid=Y0gwETw85ayLyM&imgurl=http://gybuquimicaorganica.wikispaces.com/file/view/Formula.JPG/105534689/Formula.JPG&w=176&h=179&ei=8iXtUcrtF5Ts8gT0z4GIBA&zoom=1&ved=1t:3588,r:1,s:0,i:80&iact=rc&page=1&tbnh=143&tbnw=140&start=0&ndsp=19&tx=118&ty=61
http://www.google.com.co/imgres?biw=1280&bih=856&tbm=isch&tbnid=xwDJzrf-Suny2M:&imgrefurl=http://www.kalipedia.com/popup/popupWindow.html%3Fanchor%3Dklpcnafyq%26tipo%3Dimprimir%26titulo%3DImprimir%2BArt%25C3%25ADculo%26xref%3D20080506klpcnafyq_1.Kes&docid=la9CJVRigW4DhM&imgurl=http://www.kalipedia.com/kalipediamedia/cienciasnaturales/media/200805/10/fisicayquimica/20080510klpcnafyq_2_Ies_SCO.jpg&w=530&h=200&ei=SSbtUcP-LIv69gSf1IAo&zoom=1&ved=1t:3588,r:10,s:0,i:113&iact=rc&page=1&tbnh=117&tbnw=310&start=0&ndsp=14&tx=161&ty=62
http://es.answers.yahoo.com/question/index?qid=20090616154709AAnzwta
http://medicina.usac.edu.gt/quimica/acarb/Esteres.htm
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=pPSHTFhkVvIsLM:&imgrefurl=http://www.guatequimica.com/tutoriales/accarb/Esteres.htm&docid=ZEQNhwC69EGcOM&imgurl=http://www.guatequimica.com/tutoriales/accarb/esteres.gif&w=685&h=398&ei=pCrtUZT-IoiK9AT3uICACw&zoom=1&ved=1t:3588,r:6,s:0,i:95&iact=rc&page=1&tbnh=171&tbnw=295&start=0&ndsp=19&tx=76&ty=67
http://www.google.com.co/imgres?sa=X&biw=1280&bih=856&tbm=isch&tbnid=Yr_5sb0QTtBpzM:&imgrefurl=http://es.wikipedia.org/wiki/Nomenclatura_de_funciones_org%25C3%25A1nicas_con_ox%25C3%25ADgeno&docid=jSqCIPGrC7b0FM&imgurl=http://upload.wikimedia.org/wikipedia/commons/8/8b/%2525C3%252589STERES_MONOCARBOX%2525C3%25258DLICOS.png&w=1007&h=477&ei=pCrtUZT-IoiK9AT3uICACw&zoom=1&ved=1t:3588,r:1,s:0,i:80&iact=rc&page=1&tbnh=146&tbnw=300&start=0&ndsp=19&tx=262&ty=72
http://www.google.com.co/imgres?start=115&sa=X&biw=1280&bih=856&tbm=isch&tbnid=Bvvg72ATfDj7PM:&imgrefurl=http://corinto.pucp.edu.pe/quimicageneral/contenido/72-grupos-funcionales&docid=Zdoz1VjkBlYJvM&imgurl=http://corinto.pucp.edu.pe/quimicageneral/sites/corinto.pucp.edu.pe.quimicageneral/files/images/unidad7/esteres%252520con%252520olor.jpg&w=974&h=201&ei=8SvtUevSKIOG9gST84CACw&zoom=1&ved=1t:3588,r:25,s:100,i:79&iact=rc&page=6&tbnh=59&tbnw=284&ndsp=27&tx=207&ty=12
LABORATORIO
AGUAS DURAS O BLANDAS:
1-según el orden obtenido la tendencia que se presenta es hacia las aguas intermedia por que el resultado del experimento de 10 aguas que se pusieron a prueba 6 fueron intermedias.
2-
DURA:
Se conoce como agua dura aquella que contiene un alto nivel de minerales, concreta mente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.Estos minerales son los que dificultan que otras sustancias se disuelvan correctamente en el agua, como puede ocurrir en el caso del jabón a la hora de lavar la ropa. Asimismo, las aguas duras dejan más residuos, por ejemplo la cal en desagües y tuberías, provocando así problemas en el hogar. Es por este motivo que en las zonas geográficas con aguas duras, se recomienda usar productos que eviten la formación de cal.
MEDIAS:
Aunque el agua dura y el agua blanda son las más conocidas popularmente, también podemos encontrar una dureza media del agua. Será aquella que se sitúa en los niveles intermedios entre la considerada dura y la blanda en base a la cantidad de minerales que posee.
BAJAS:
Por el contrario, el agua blanda es el agua en la que se encuentran disueltas mínimas cantidades de sales. Suelen corresponder a las aguas de pozo o aquellas que proceden de aguas superficialesEl agua más blanda es el agua destilada, por el hecho de no poseer ningún mineral y no es apta para el consumo humano.
3-
SE PUEDE EXPLICAR POR QUE EL AGUA DEL MAR ES SALADA?
pues con este experimento no estamos seguros de si se podría explicar si el agua de mar es salada pero por lo que sabemos el agua de mar es salada por que cada litro de agua de mar contiene 37 gramos de sal.
4- QUE TIPO DE AGUA MINERAL RECOMENDARÍA PARA UNA PERSONA QUE SUFRE DE PRESIÓN ALTA? Para una persona con presión alta es mejor que no tome agua dura ni que contenga sales porque esto es dañoso para la persona, puede ocasionar que la tensión se eleve, lo mejor es una agua blanda sin sales minerales.
QUE TIPO DE AGUA MINERAL RECOMENDARÍA PARA UNA PERSONA QUE SUFRE DE PRESIÓN BAJA? Para una persona con presión arterial baja ocurre lo opuesto, hay que tomar aguas minerales con alto contenido en sales minerales, porque esto ayuda a elevar la tensión. También es mejor tomar el agua fría o a temperatura ambiente porque esto también es bueno para la tensión baja.
5-¿ES BENEFICIOSO PARA LA SALUD EL CONSUMO DE AGUA DESTILADA?
El agua destilada puede traer varios beneficios para la salud, incluso hay doctores que recomiendan tomar agua destilada porque es mas pura que la otra agua.
Aunque también tiene sus riesgos para algunas personas, porque el agua destilada carece de algunos minerales o sales que son beneficiosos para el cuerpo humano y a falta de esto el cuerpo puede tender a decaer.
6-¿QUE INCONVENIENTE APAREJANDO EL USO DE AGUA BLANDA COMO MEDIO DE LIMPIEZA?
El agua blanda no presenta ningún inconveniente para los productos de limpieza porque son mas fáciles de mezclar y combinarse con los productos de aseo
7-¿QUE INCONVENIENTE APAREJANDO EL USO DE AGUA DURA COMO MEDIO DE LIMPIEZA?
Las aguas duras cuando entran en contacto con el jabón reducen su capacidad de crear espuma obligando a aumentar el tiempo de uso.Los detergentes también son afectados forzando a emplear mayor concentración del producto para cumplir su misión de lavado.
AGUAS DURAS, AGUAS BLANDAS
INTRODUCCIÓN :
El agua es un componente fundamental para la vida, tal como la conocemos; es por eso qué su consumo y cuidado son muy importantes.
Durante el ultimo siglo, los niveles de contaminación de este presenciado producto se han visto incrementado en niveles inimaginables, produciendo la muerte de muchos organismos que utilizan el agua como medi de transporte y de desenvolvimiento y como componente fundamental de la dieta alimenticia.
Respecto a la contaminación del agua, preocupa mucho los contenidos de sales inorganicas disueltas en ella, produciendo, muchas veces, que el agua se torne dañina para el organismo, produciendo enfermedades renales, como cálculos renales qué corresponden a la acumulación de sal, y su posterior formación de piedrecitas en los nefrones. También puede producir alzas depresión sanguínea.
Es importante agregar que la contaminación del agua, produce problemas a nivel agricola, ya que no permite el desarrollo normal de las cosechas originando millones de pérdidas en los negocios. Además, accidentalmente caen al agua los pesticidas y fungicidas utilizados en las faenas agrícolas, agravando aún más la situación.
El agua que contiene altos niveles de sal se denomina agua dura, y existe varios procesos para ablandarla o disminuir varios procesos para ablandarla o disminuir sus desniveles salinos, previniendo enfermedades y problemas industriales, ya que se requieren mas calor para hervir aguas duras que aguas blandas, lo que conlleva un gran gastos de recursos y baja eficacia en los procesos esto también produce problemas en nuestro hogares.
PROCEDIMIENTO
Discriminaremos entre diversas muestras de aguas la presencia de contenido salino, clasificando en aguas duras y blandas, mediante el principio de formación de espuma.
Materiales:
Jabón líquido
Muestras de agua.
7 a 10 botellas plásticas con tapa.
Agua corriente.
Papel y lápiz para la confección de una tabla
Lana, pita o hilo.
Una regla.
PROCEDIMIENTO
Numerar con su respectivo nombre las botellas.
A cada botella agréguele 6 cm de la muestra, teniendo en cuenta de anotar el número de la botella y el tipo de muestra.
A cada botella añádele una muestra de jabón líquido aproximadamente una cucharada.


Una vez tenga todas las botellas con jabón y bien tapada, agite vigorosamente y deje reposar unos segundos.


Mida la altura de la columna de jabón con la pita, el hilo o la lana, y luego utilice la regla para medir la pita. Esto para que las mediciones sean más precisas.

El agua es un componente fundamental para la vida, tal como la conocemos; es por eso qué su consumo y cuidado son muy importantes.
Durante el ultimo siglo, los niveles de contaminación de este presenciado producto se han visto incrementado en niveles inimaginables, produciendo la muerte de muchos organismos que utilizan el agua como medi de transporte y de desenvolvimiento y como componente fundamental de la dieta alimenticia.
Respecto a la contaminación del agua, preocupa mucho los contenidos de sales inorganicas disueltas en ella, produciendo, muchas veces, que el agua se torne dañina para el organismo, produciendo enfermedades renales, como cálculos renales qué corresponden a la acumulación de sal, y su posterior formación de piedrecitas en los nefrones. También puede producir alzas depresión sanguínea.
Es importante agregar que la contaminación del agua, produce problemas a nivel agricola, ya que no permite el desarrollo normal de las cosechas originando millones de pérdidas en los negocios. Además, accidentalmente caen al agua los pesticidas y fungicidas utilizados en las faenas agrícolas, agravando aún más la situación.
El agua que contiene altos niveles de sal se denomina agua dura, y existe varios procesos para ablandarla o disminuir varios procesos para ablandarla o disminuir sus desniveles salinos, previniendo enfermedades y problemas industriales, ya que se requieren mas calor para hervir aguas duras que aguas blandas, lo que conlleva un gran gastos de recursos y baja eficacia en los procesos esto también produce problemas en nuestro hogares.
PROCEDIMIENTO
Discriminaremos entre diversas muestras de aguas la presencia de contenido salino, clasificando en aguas duras y blandas, mediante el principio de formación de espuma.
Materiales:
Jabón líquido
Muestras de agua.
7 a 10 botellas plásticas con tapa.
Agua corriente.
Papel y lápiz para la confección de una tabla
Lana, pita o hilo.
Una regla.
PROCEDIMIENTO
Numerar con su respectivo nombre las botellas.
A cada botella agréguele 6 cm de la muestra, teniendo en cuenta de anotar el número de la botella y el tipo de muestra.
A cada botella añádele una muestra de jabón líquido aproximadamente una cucharada.


Una vez tenga todas las botellas con jabón y bien tapada, agite vigorosamente y deje reposar unos segundos.



Para qué la medición sea más objetiva, midan con una lana, y luego midan con una regla el trozo de lana utilizada, la altura de espuma que se forma desde el nivel del agua. Anoten las medidas y ordenarlas de menor a mayor, indicando a quien corresponde cada altura.
Una vez realizadas todas las observaciones, confeccionarán una tabla con 3 columnas: en la primera indicarán la sustancia evaluada, en la segunda la altura de espuma obtenida, y en la tercera indicarán si creen que corresponde a agua dura o blanda, teniendo como referencia de agua blanda al agua corriente
Integrantes:
Florez Mendez Hamilton Asmert
Lopez Aranda Leonardo
Martinez Vasquez Bryan Andres
Uribe Florez Elver Jose
Lopez Aranda Leonardo
Martinez Vasquez Bryan Andres
Uribe Florez Elver Jose